很少有化学品像硫酸那样以多种方式影响人类生活。它被用于生产数千种日常消费品,并被认为是最重要的工业化学品之一。
硫酸是什么?
硫酸(也称为硫酸或氢硫酸盐)是一种浓稠的无色液体,化学式为 H2SO4,摩尔质量为 98.079 g/mol,分子密度为 1.84 kg/L(水为 1 kg/L),沸点为 337°C。H2SO4 具有油状粘稠性,尤其是浓缩形式,看起来像透明的浓稠糖浆。由于其油腻外观,早年曾被称为硫酸油(现在仅用于浓缩商业品)。然而,与普通油不同,硫酸是一种强酸,具有高度腐蚀性。
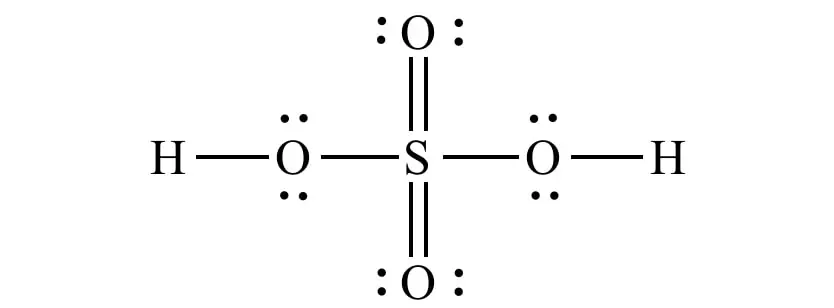
H2SO4 的结构式。图片来源:互联网
在最纯净的形式下,H2SO4 溶液是一种高腐蚀性的液体,pH 值为 0.5,可与任何浓度的水混合稀释。长期接触低浓度或短期接触高浓度可能对健康有害。浓硫酸非常危险,接触会导致皮肤灼伤和严重组织损伤。
为什么 H2SO4 具有高腐蚀性?
硫酸高度腐蚀性的两个主要原因如下:
- 首先,它是一种极强的脱水剂,能与水强烈结合。具体来说,当 H2SO4 与任何含水或潮湿空气的固体接触时,它会迅速吸收水分并使材料干燥。由于这一过程可能非常剧烈,它可以引发许多有机材料(如木材、纸张或糖)的燃烧反应,并留下碳渣。
由于这种与水的特性,纯浓硫酸在自然界中不存在。尽管火山活动可能产生氢硫酸盐和火山喷发形成的硫酸气溶胶,这些气溶胶可在平流层中存在多年,但随后这些气溶胶可能转化为 SO2,这是酸雨的组成部分。
- 第二个特性是硫酸容易电离。在稀硫酸溶液中,氢和硫酸根 (SO42-) 离子分离,形成大量水合氢离子和自由负电荷的硫酸根离子,这些离子能够与其他原子结合。因此,H2SO4 容易与许多金属、碳、硫及其他物质反应。
H2SO4 如何制备?
硫酸由硫制成。首先,通过燃烧熔融硫获得二氧化硫 (SO2)。然后,在五氧化二钒催化剂的作用下,SO2 转化为三氧化硫 (SO3)。

H2SO4 的制备过程如下:
步骤 1:制备二氧化硫
S(s) + O2(g) → SO2 (g)
步骤 2:制备三氧化硫
当二氧化硫与氧以 1:1 比例在 400–450°C、1–2 atm 条件下并在 V2O5(五氧化二钒)催化剂存在下反应时,生成三氧化硫。该反应是可逆的,在相同条件下可向两个方向进行。
2SO2(g) + O2(g) ⇌ 2SO3(g)
步骤 3:制备浓硫酸
最初生成的三氧化硫与硫酸溶液反应。三氧化硫不能直接溶于水,因为会形成雾状物。该反应的产物是 H2S2O7,也称为烟酸、二硫酸或焦硫酸(一种硫氧酸)。最后,将所得烟酸溶解于水中以制备浓硫酸。
H2SO4 + SO3(g) → H2S2O7(l)
H2S2O7(l) + H2O(l) → 2H2SO4
浓硫酸的安全稀释方法
稀释硫酸是实验室和工业生产中的常见操作。根据不同的应用,这种强氧化剂的浓度可能有所不同。通常使用水来稀释浓硫酸。然而,如果操作不当,这个过程存在风险。理解并遵循正确的操作步骤不仅能保证安全,还能保持溶液质量,并确保实际应用的效果。
如前所述,硫酸具有极强的腐蚀性,并且与水剧烈反应,释放大量热量,尤其是在浓缩状态下。因此,稀释必须受到控制,以确保操作人员和周围环境的绝对安全。应佩戴个人防护装备,包括安全护目镜、耐化学手套、实验服,必要时佩戴防毒面具。使用玻璃或耐酸材料的器具,并在通风良好的通风柜中或有应急处理系统的区域进行操作。
最重要的原则是:始终将酸加入水中,绝不可反过来。原因如下:
- 当缓慢将浓硫酸加入水中时,较重的酸会下沉,释放的热量被水吸收,从而减少局部沸腾和溅出风险。水与酸的突然接触会因反应放热而产生蒸汽。
- 相反,水比硫酸轻得多。如果将水倒入酸中,水会浮在上面,只有很小的接触面积。当水与酸接触时,反应立即发生,引起剧烈沸腾、蒸汽和溅出,可能将溶液从容器中喷出。

在稀释浓硫酸时应始终将浓硫酸加入水中以确保安全。图片来源:互联网
安全稀释浓硫酸的正确步骤如下:
1. 防护装备:佩戴安全护目镜、手套、防毒面具、实验服等。同时,准备应急措施,如安全淋浴、洗眼盆以及酸中和剂(例如碳酸氢钠)。
2. 使用器具:使用耐热玻璃器皿或专用塑料容器,能抵抗强无机酸腐蚀。准备玻璃搅拌棒或带加热功能的磁力搅拌器。
3. 稀释操作:先将蒸馏水倒入容器中。然后,缓慢分批将浓硫酸加入水中,并持续搅拌以分散热量。加入酸时绝不可停止搅拌。操作应缓慢进行,以防局部过热、热冲击、容器破裂或剧烈反应。操作过程中保持容器固定并确保良好通风。
4. 冷却与储存:稀释完成后,让溶液完全冷却再使用或储存。容器应清楚标明浓度、配制日期、操作人员及必要的安全警示。操作和储存必须遵守危险化学品相关规定。
H2SO4 的用途
由于其强大的化学特性,如高酸性、吸水性和强氧化性,硫酸可以在家庭中使用,但主要广泛应用于各类工业,并被认为是最重要的工业化学品之一。
家庭清洁:
由于危险性较高,硫酸不建议用于一般家庭清洁。然而,在特殊情况下,这种高腐蚀性化学品主要用于去油剂和下水道清洁剂(用于腐蚀和快速分解导致堵塞的有机废物,使家庭疏通管道更容易),但仅在严格控制的浓度下使用并有明确警示。它是一种非常危险的化学品,需要谨慎处理。
家庭使用硫酸疏通下水道的注意事项:
-
使用前仔细阅读说明。
-
始终佩戴适当的防护装备,包括手套、护目镜和防毒面具,以保护自己免受飞溅液体或烟雾伤害。
-
通风:确保操作区域通风良好。打开窗户或使用排风扇,以减少疏通过程中产生的有毒烟雾。
-
切勿将含硫酸的产品与任何其他化学品或清洁剂混合,这可能引发危险化学反应,释放有毒气体并带来火灾和爆炸风险。
-
急救:如硫酸溅到皮肤上,立即用大量水冲洗受影响部位,并及时寻求医疗帮助。
-
储存于阴凉、通风良好的地方,远离儿童、宠物和易燃物。如果硫酸溢出或容器泄漏,应妥善清理以防扩散。
H2SO4 在工业中的应用
1. 化学品生产
硫酸是化学工业中最重要的基础化学品之一。凭借其特有的化学特性,它在许多基础化学品生产过程中直接或间接参与,作为反应物、中间体和大规模合成链中的催化剂。例如,它可用作中间体生产其他有用酸,如硝酸(与硝酸盐如 KNO3、NaNO3 反应)和盐酸(与氯化钠反应)。它还可用于生产合成清洁剂、颜料和染料,以及硫酸盐。
2. 金属加工
硫酸在金属加工中被广泛使用。金属加工包括加热、冷却和塑形金属,以制造钢、铁或铜制品(例如车辆、计算机组件、建筑、管道、住房材料等)。
硫酸用于一种称为“酸洗”的混合物中,这是一种表面处理工艺,用于去除金属上的锈蚀或碳杂质,以完成金属表面处理,这是金属处理的最后且最重要的阶段之一。它还用于电镀前清洗金属。
3. 电池生产
这种化学品(CAS 7664-93-9)与铅结合产生反应,生成足够的电子以提供大电池(如汽车和拖拉机用电池)所需的电压。因此,它有时被称为“电池酸”,是电池产生能量的关键成分。
4. 家用和工业清洁产品
由于其极强的腐蚀性,硫酸是许多清洁剂和下水道疏通剂的主要成分。它还用于生产硫酸盐、炸药、橡胶和塑料、染料、纸张、纺织品、油漆、灭火器和消毒剂。
5. 制药
-
硫酸用于化疗药物生产中破坏癌细胞 DNA。
-
它用于制造镇静剂(地西泮/安定)、止痛、退烧和抗炎药(阿司匹林、对乙酰氨基酚)、抗生素(氯霉素)、抗炎药(泼尼松龙)、抗菌药(磺胺药)以及合成皮质类固醇。
-
它也是 Debacterol 软膏的基本成分,用于治疗各种皮肤感染和口腔溃疡。
6. 食品加工
为什么在食品中使用这种有毒酸?亚硫酸盐和二氧化硫有助于防止食物变质和有害物质(如亚硝胺)的生成。这种强无机酸用于破坏水果和蔬菜的细胞壁以便更容易消化,或通过杀死细菌和真菌来保存食品。
7. 石油和燃料生产
虽然不直接参与碳氢化合物裂解,但硫酸在裂解后的处理过程中间接用于生成更易处理的化合物,然后再精炼成汽油和天然气。
具体来说,它主要用于烷基化过程,作为催化剂生成高辛烷值的烷基化物,是清洁无铅燃料的重要成分。它还用于油品处理以去除不稳定的有机杂质,如树脂和含氮化合物,提高汽油、柴油和润滑油的颜色和稳定性。
硫酸还参与生产磺酸表面活性剂,用作燃料和润滑油添加剂。
8. 废物管理
许多工业废物被倾倒在填埋场。硫酸用于中和有机物并防止有毒气体释放,同时充当催化剂分解材料中的化学键。美国 EPA 对硫酸排放量设有限制,但它仍然对人体有害。
9. 农业应用
硫酸在农业中最大的用途是生产化肥。磷酸从磷矿石中提取,并用氢硫酸处理,生成无机磷肥,如硫酸铵和过磷酸钙。这些肥料被施用于田地,为作物提供养分。
在越南哪里购买可靠的 H2SO4?
如果您希望以合理价格购买高质量硫酸用于生产、实验室、学校等,KPTCHEM 将是您的理想供应商。作为越南领先的 H2SO4 供应商之一,KPTCHEM 拥有高素质的团队和专业罐车车队,可提供质量优良且成本最优的产品。我们不仅提供国内配送,还可国际运输,同时确保化学品的最佳质量。请随时联系我们的咨询团队,获得全天候 24/7 的快速支持。
常见问题
浓硫酸在制糖厂的用途?
在甘蔗加工中,原汁含有杂质,如泥土、有机物、微生物、色素和矿物盐。为了使甘蔗汁更清澈并提高糖的结晶效率,工厂通过使用稀释的浓硫酸调节 pH,将甘蔗汁的 pH 降至最佳水平,帮助杂质沉淀和去除。在亚硫酸处理工艺中,轻微酸性环境有助于 SO2 更好地反应,使糖色亮丽稳定。
在离子交换系统中,硫酸用于再生阳离子树脂,当树脂的交换能力耗尽时使用。此外,在石灰处理后,甘蔗汁可能过碱,H2SO4 用于中和多余的碱,确保安全并满足环境标准。
H2SO4 会使石蕊试纸变成什么颜色?
答案:红色。硫酸是强酸,会完全离解成氢离子 (H+) 和硫酸根离子 (SO42-)。H+ 离子使石蕊试纸变红。
稀硫酸与哪些金属反应?
像其他酸一样,稀硫酸与金属反应产生氢气和金属硫酸盐。可反应的金属包括铁 (Fe)、铝 (Al)、锌 (Zn)、锰 (Mn) 和镁 (Mg)。
稀硫酸不会与铜 (Cu)、银 (Ag) 和金 (Au) 反应。
为什么蔗糖在浓硫酸中会变黑?
硫酸是强酸,也是脱水剂。它会向水中添加质子 (H+),形成水合氢离子 (H3O+),去除水分。对于碳水化合物(糖、葡萄糖、淀粉、纤维素等),硫酸会从碳原子上去除羟基 (-OH) 群。
蔗糖 (C12H22O11) 与其他碳水化合物一样,醛缩键被破坏。反应产生碳和水,并释放足够的热量生成黑色蒸汽:
C12H22O11 → 12C + 11H2O
它对淀粉、纤维素甚至人体组织也有类似作用。这就是为什么使用浓硫酸极其危险,在操作、生产或实验时必须佩戴防护装备。



